أحادي كلوريد اليود
مركب كيميائي
أحادي كلوريد اليود هو مركب بين هالوجيني صيغته ICl، ويوجد منه شكلان حسب البنية وهما ألفا وبيتا، ويوجد في الشروط القياسية على شكل صلب بلوري ذي لون بني محمر، والذي ينصهر بالقرب من درجة حرارة الغرفة.
| أحادي كلوريد اليود | |
|---|---|
 |
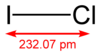 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Iodine monochloride |
|
| المعرفات | |
| CAS | 7790-99-0 |
| بوب كيم | 24640[1] |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | ICl |
| الكتلة المولية | 162.36 غ/مول |
| المظهر | صلب/سائل بني محمر |
| الكثافة | 3.10 غ/سم3 |
| نقطة الانصهار | 14 °س (الشكل بيتا β) 27 °س (الشكل ألفا α) |
| نقطة الغليان | 94 °س (يتفكك) |
| الذوبانية في الماء | يتحلل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
التحضير
عدليحضّر المركب من التفاعل المباشر بين عنصري الكلور واليود:
الخواص
عدليوجد شكلان من المركب يختلفان من حيث البنية البلورية، وهما ألفا α وبيتا β. يكون ICl-α على شكل بلورات حمراء إبرية، أما ICl-β بلورات معينة قائمة متطاولة ذات لون بني محمر.[2]
يتفكك المركب عند التماس مع الماء بتفاعل حلمهة ليعطي كلوريد الهيدروجين بالإضافة إلى اليود:
الاستخدامات
عدليستخدم المركب في المختبرات الكيميائية لإجراء عملية اليوددة.[2][3]
طالع أيضاً
عدلمراجع
عدل- ^ ا ب ج د IODINE MONOCHLORIDE (بالإنجليزية), QID:Q278487
- ^ ا ب Brisbois, R. G.; Wanke, R. A.; Stubbs, K. A.; Stick, R. V. "Iodine Monochloride" Encyclopedia of Reagents for Organic Synthesis, 2004 John Wiley & Sons. دُوِي:10.1002/047084289X.ri014
- ^ Wallingford, V. H.; Krüger, P. A.(1943)."5-Iodo-anthranilic Acid". Org. Synth.; Coll. Vol. 2: 349.
