أكسيد البوتاسيوم
أكسيد البوتاسيوم هو مركب أيوني للبوتاسيوم والأكسيجين له الصيغة K2O. هذا الأكسيد الأصفر الشاحب الصلب هو أبسط أكاسيد البوتاسيوم، وهو مركب صعب التواجد وشديد النشاط الكيميائي. تفحص بعض المواد التجارية، كالأسمدة والإسمنت، ليكون نسبة تركيبها مكافئة لـ K2O.
| أكسيد البوتاسيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
أكسيد البوتاسيوم |
|
| تسمية الاتحاد الدولي للكيمياء | |
بوتاسيوم أوكسيدو بوتاسيوم |
|
| أسماء أخرى | |
أحادي أكسيد البوتاسيم |
|
| المعرفات | |
| رقم CAS | 12136-45-7 |
| بوب كيم | 9989219[1] |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | K2O |
| الكتلة المولية | 94.20 غ/مول |
| المظهر | صلب أصفر شاحب |
| الكثافة | 2.35 غ/سم3 |
| نقطة الانصهار | >350 °س يتفكك. |
| الذوبانية في الماء | يتفاعل معطياً KOH |
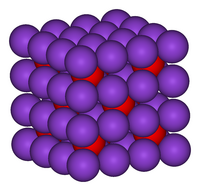
| البنية | |
| البنية البلورية | فلوريت (cubic), رمز بيرسون |
| زمرة فراغية | Fm3m, No. 225 |
| التنسيق الهندسي | Tetrahedral (K+); cubic (O2–) |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−361 كيلو جول.مول−1[2] |
| إنتروبيا مولية قياسية S |
98 كيلو جول.مول−1[2] |
| المخاطر | |
| صحيفة بيانات سلامة المادة | ICSC 0769 |
| فهرس المفوضية الأوروبية | غير مذكور |
| مخاطر | مخرش, يتفاعل بعنف مع الماء |
| نقطة الوميض | غير مشتعل |
| مركبات متعلقة | |
| أنيونات أخرى | كبريتيد البوتاسيوم |
| كتيونات أخرى | أكسيد الليثيوم أكسيد الصوديوم أكسيد الروبيديوم أكسيد السيزوم |
| بوتاسيوم أكسيد ذات علاقة | فوق أكسيد البوتاسيوم فائق أكسيد البوتاسيوم |
| مركبات ذات علاقة | هيدروكسيد البوتاسيوم |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الإنتاج
عدلينتج أكسيد البوتاسيوم من تفاعل الأكسجين مع البوتاسيوم؛ كما يحدث في تفاعل بيروكسيد البوتاسيوم K2O2، حيث ينتج أكسيد البوتاسيوم عند معالجته بالبوتاسيوم، كما في المعادلة:[3]
- K2O2 + 2 K → 2 K2O
أو يمكن تحضير K2O بسهولة أكبر عن طريق تسخين نترات البوتاسيوم مع البوتاسيوم الفلزي:
- 2 KNO3 + 10 K → 6 K2O + N2
لا يمكن إزالة الماء من هيدروكسيد البوتاسيوم للحصول على الأكسيد.
الخواص والتفاعلات
عدلبنية بلورات K2O هي بنية معاكسة لبنية الفلوريت. أي أن مواقع الأيونات والكاتيونات معكوسة بالنسبة لموقعها في CaF2.[4][5] وأكسيد البوتاسيوم هو أكسيد قلوي ويتفاعل مع الماء بعنف معطياً هيدروكسيد البوتاسيوم الكاوي. وهو مادة متميعة وستمتص الماء من الجو بادئة هذا التفاعل القوي.
الأسمدة
عدلتستخدم الصيغة الكيميائية K2O في تحديد رقم N-P-K (نيتروجين-فوسفور-بوتاسيوم) في اللصاقات الموجودة على الأسمدة. لا يستخدم K2O كسماد فعلياً بالرغم من أنها الصيغة الصحيحة لأكسيد البوتاسيوم، بل عادة ما يستخدم كلوريد البوتاسيوم أو كبريتات البوتاسيوم أو كربونات البوتاسيوم كمصدر للبوتاسيوم. نسبة K2O الموجودة على اللصاقة تشير فقط إلى مقدار البوتاسيوم في السماد لو أنه كان على شكل أكسيد بوتاسيوم. حيث يشكل البوتاسيوم حوالي 83% من وزن أكسيد البوتاسيوم في حين يشكل 60% من وزن كلوريد البوتاسيوم. لذا فكلوريد البوتاسيوم يحوي بوتاسيوم أقل من كمية مماثلة من أكسيد البوتاسيوم. لذا فإذا كان السماد يحتوي على 30% من وزنه كلوريد بوتاسيوم، فإن رقم البوتاسيوم القياسي اعتماداً على أكسيد البوتاسيوم سيكون 21.7%.
المراجع
عدل- ^ Dipotassium oxide (بالإنجليزية), QID:Q278487
- ^ ا ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ص. A22.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5. "نسخة مؤرشفة". مؤرشف من الأصل في 2016-03-03. اطلع عليه بتاريخ 2014-05-11.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Zintl, E.; Harder, A.; Dauth B. (1934)، "Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums"، Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie، ج. 40، ص. 588–93
{{استشهاد}}: استعمال الخط المائل أو الغليظ غير مسموح:|صحيفة=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Wells, A.F. (1984)Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.