التنكس الإسفنجي للجهاز العصبي المركزي
التنكس الإسفنجي للجهاز العصبي المركزي، يُعرف أيضًا باسم داء كانافان (سي دي)، أو نوع فان بوغارت أو عجز أسيلاز الأسبارتات (إيه إس بّي إيه)، هو أحد أمراض التحلل العصبي الجسدية المتنحية. ينتمي هذا المرض إلى مجموعة الاضطرابات الجينية المعروفة باسم حثل المادة البيضاء، التي تتميز بحدوث خلل في نمو غمد الميالين والحفاظ عليه في الجهاز العصبي المركزي (سي إن إس).[1] يوجد ثلاثة أنواع من التنكس الإسفنجي: الطفلي، والخلقي واليفعي، إذ يمثل التنكس الإسفنجي اليفعي النوع الأشد بينها.[2] تشمل الأعراض الشائعة لدى الرضع كلًا من افتقار المهارات الحركية، وضعف التوتر العضلي وضخامة الرأس. قد يترافق هذا أيضًا مع صعوبات في التغذية والبلع، والنوبات واضطرابات النوم. في الحالات النموذجية، يموت الأطفال المصابون قبل عمر 10 سنوات، إلا أن متوسط العمر المتوقع متنوع بين الحالات.[3]
| التنكس الإسفنجي للجهاز العصبي المركزي | |
|---|---|
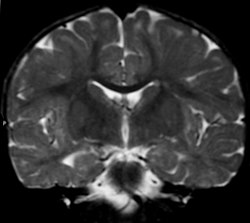
تظهر فحوصات التصوير بالرنين المغناطيسي خلل الميالين، وهو مؤشر محتمل لمرض كانافان
| |
| تعديل مصدري - تعديل |
يحدث التنكس الإسفنجي للجهاز العصبي المركزي نتيجة طفرة في الجين المشفر لأسيلاز الأسبارتات (إيه إس بّي إيه)، الذي يمثل الإنزيم المسؤول عن حلمهة حمض إن-أسيتيل الأسبارتيك (إن إيه إيه).[4] يؤدي غياب «إيه إس بّي إيه» إلى تراكم «إن إيه إيه» متسببًا في التنكس الإسفنجي. ما تزال الأسباب الفيزيولوجية المرضية الدقيقة للمرض غير واضحة في الوقت الحالي، لكن يوجد العديد من النظريات قيد التطوير. يمكن تشخيص التنكس الإسفنجي من خلال تقنيات التصوير العصبي وتحليل البول. لا يوجد علاج حالي للتنكس الإسفنجي، لكن يوجد عدد من الأبحاث الحالية التي تستخدم العلاج الجيني بهدف علاج المرض. لُوحظ حدوث التنكس الإسفنجي بشكل أكثر انتشارًا بين يهود الأشكناز، إذ يبلغ معدل الوقوع 1/6000 لدى هذه المجموعة العرقية.[5][6]
الأعراض السريرية
عدليمكن تصنيف التنكس الإسفنجي للجهاز العصبي المركزي في ثلاثة أنواع، الطفلي، واليفعي والخلقي؛ بالاعتماد على عمر بدء المرض وشدة الأعراض.
النوع الطفلي
عدليمثل النوع الطفلي النوع الأكثر شيوعًا من التنكس الإسفنجي للجهاز العصبي المركزي. يتميز الأطفال المصابون عادة بمظهر طبيعي خلال الشهور القليلة الأولى من حياتهم. يبدأ ظهور المرض في عمر 6 أشهر تقريبًا، إذ يبدأ الطفل في تطوير حالات ملحوظة من العجز النفسي الحركي. تتأثر المهارات الحركية المختلفة بما في ذلك القدرة على التقلب واستقرار حركات الرأس. لُوحظ أيضًا حدوث نقص التوتر وضخامة الرأس في الشهور القليلة الأولى.[7]
خلال النصف الثاني من السنة الأولى، يبدأ معظم الأطفال في الفشل بالاستجابة للمنبهات البصرية، مع ملاحظة نوبات من حركات العين الرمشية، ما يسبب العمى لدى غالبيتهم في السنة الثانية من العمر. [7]
تشمل أعراض المرحلة الأخيرة من تطور المرض كلًا من التعرق، والتقيؤ، وفرط الحرارة، والنوبات وانخفاض ضغط الدم، إذ تنتهي هذه المرحلة عادة بموت الطفل. يختلف متوسط العمر المتوقع بين الأطفال المصابين، لكن لا يتمكن معظمهم من البقاء حتى سن العشر سنوات.
النوع الخلقي
عدليبدأ ظهور المرض نموذجيًا بعد أيام قليلة من الولادة في النوع الخلقي. لا يحمل المرض أي تأثيرات على الحمل وعملية الولادة إذ يولد الطفل بمظهر طبيعي دون مشاكل صحية ظاهرة. مع ذلك، قد يعاني الأطفال المصابون من الخمول في الأيام التالية للولادة مع صعوبات في مختلف الحركات مثل المص والبلع. مع ترقي المرض، يختبر المرضى تدهورًا في التوتر العضلي وتعطل رد فعل مورو، الذي يُعرف أيضًا باسم المنعكس الإجفالي. قد يؤدي ذلك إلى تطور تنفس تشاين ستوكس بعد أسابيع أو حتى أيام قليلة من الولادة، ما قد يسبب الموت.[8]
النوع اليفعي
عدليبدأ النوع اليفعي في الظهور في عمر الخمس سنوات تقريبًا. يتمكن معظم المرضى المصابين بالنوع اليفعي من البقاء على قيد الحياة حتى سن المراهقة المتأخرة. يختبر الأطفال المصابون نموذجيًا تطور متلازمة المخيخ المترقية والتدهور العقلي، الذي يتبعه فقدان البصر، والضمور البصري والتقبض المعمم. بعكس النوع الطفلي، لا يختبر الطفل المصاب ضخامة في الرأس. [9]
الوسائل العلاجية
عدللا يوجد في الوقت الحالي أشكال علاجية معينة للتنكس الإسفنجي في الجهاز العصبي المركزي. تخضع بعض الوحدات العلاجية المحددة للدراسات التجريبية ويتلقى المرضى الحاليون الدعم عبر الإجراءات التلطيفية الموضحة أدناه.
الإجراءات التلطيفية الحالية
عدليحصل المرضى الحاليون على الدعم من إرشادات الرعاية لأمراض الأطفال التنكسية العصبية الأخرى. بالنسبة للمرضى المصابين بمشاكل في الجهاز التنفسي، يمكن استخدام آلات الشفط الطبي من أجل إزالة المخاط من المجاري التنفسية العلوي للرئتين. تُستخدم أجهزة توليد الأكسجين أيضًا بهدف تفريغ مجرى الهواء والإمداد المستمر بالهواء للمساعدة على التنفس. بالنسبة للرضع المصابين بنقص التوتر، يشمل العلاج توفير معدات ضبط الوضعية مثل عربات الأطفال المخصصة، وكراسي الاستحمام ومقاعد التغذية.[5]
الوحدات العلاجية المحتملة قيد التطوير
عدلحقن حمض الليبويك داخل الصفاق
عدلخضع حمض الليبويك، الذي يستطيع عبور الحاجز الدماغي الشوكي، مؤخرًا للاختبار في الدراسات قبل السريرية، التي شملت حقنه داخل الصفاق لدى الفئران المصابة بالرعاش. تُعتبر الفئران المصابة بالرعاش إحدى النماذج الطبيعية للتنكس الإسفنجي للجهاز العصبي المركزي الناجم عن الإجهاد التأكسدي المحرض بواسطة «إن إيه إيه». أظهرت هذه الدراسات نتائج إيجابية، ما يشير إلى إمكانية استخدام حمض الليوبيك كنهج محتمل للعلاجات المركزة على الأعراض.
إعطاء الليثيوم داخل الصفاق
عدلتتمثل إحدى العلاجات المحتملة في استخدام تقنيات الوقاية العصبية بهدف تعويض التلف العصبي للجهاز العصبي المركزي الناجم عن تراكم «إن إيه إيه». يُعتبر الليثيوم أحد هذه العلاجات المحتملة المحددة، إذ لُوحظت قدرته على إحداث تأثيرات وقائية عصبية لدى مرضى الخرف. خضع إعطاء الليثيوم داخل الصفاق للاختبار لدى كل من الفئران المصابة بالرعاش وفئران النوع البري، إذ أدى ذلك إلى انخفاض مستويات «إن إيه إيه» في كلا النوعين. في التجارب البشرية، لُوحظ انخفاض مستويات «إن إيه إيه» في الدماغ والبول بعد سنة واحدة من العلاج. ترافق هذا مع ارتفاع مستوى اليقظة والتتبع البصري. مع ذلك، استمرت أعراض التنكس الإسفنجي بما في ذلك نقص التوتر المحوري والشلل المزدوج التشنجي.[10]
العلاج الجيني
عدلنظرًا إلى حدوث التنكس الإسفنجي نتيجة خلل أحادي الجين إلى جانب تموضعه في الجهاز العصبي المركزي، يبرز علاج الاستبدال الجيني كأحد العلاجات المحتملة للمرض. يشمل هذا العلاج استبدال جين كامل وظيفيًا بالجين الطافر للمرض بواسطة الناقل؛ الذي ينقل الدنا العلاجية إلى داخل الخلايا، ما يسمح للخلايا بإنتاج «إيه إس بّي إيه». تُستخدم الفيروسات المرتبطة بالغدية (إيه إيه في إس) على نطاق واسع كناقلات من أجل العلاج الجيني. اعتمد العلاج الجيني هذه الفيروسات لعدم قدرتها على نسخ نفسها ولاعتبارها تقريبًا غير سامة. يوجد نوعان من الأنماط المصلية المستخدمة من أجل العلاج: «إيه إيه في 2» و«إيه إيه في 9». يكمن الاختلاف بين هذين النمطين المصليين في عدم قدرة «إيه إيه في 2» على عبور الحاجز الدماغي الدموي (بي بي بي)، بينما يستطيع «إيه إيه في 9» تجاوز «بي بي بي»، ما يسمح بإجراء العلاج في المراحل المتأخرة من المرض. مع ذلك، تشير الأبحاث الحالية إلى قدرة الفيروسات المرتبطة بالغدية على تحريض الاستجابات المناعية غير المرغوبة لدى الأطفال بالإضافة إلى سعة تمحفظ الجين المحدودة.[11]
المراجع
عدل- ^ Baslow MH، Guilfoyle DN (أبريل 2013). "Canavan disease, a rare early-onset human spongiform leukodystrophy: insights into its genesis and possible clinical interventions". Biochimie. ج. 95 ع. 4: 946–56. DOI:10.1016/j.biochi.2012.10.023. PMID:23151389.
- ^ Namboodiri AM، Peethambaran A، Mathew R، Sambhu PA، Hershfield J، Moffett JR، Madhavarao CN (يونيو 2006). "Canavan disease and the role of N-acetylaspartate in myelin synthesis". Molecular and Cellular Endocrinology. ج. 252 ع. 1–2: 216–23. DOI:10.1016/j.mce.2006.03.016. PMID:16647192. S2CID:12255670.
- ^ Matalon RM، Michals-Matalon K (مارس 2000). "Spongy degeneration of the brain, Canavan disease: biochemical and molecular findings". Frontiers in Bioscience. ج. 5: D307-11. DOI:10.2741/matalon. PMID:10704428.
- ^ Ahmed SS، Gao G (2014). "Making the White Matter Matters: Progress in Understanding Canavan's Disease and Therapeutic Interventions Through Eight Decades". JIMD Reports. Berlin, Heidelberg: Springer Berlin Heidelberg. ج. 19: 11–22. DOI:10.1007/8904_2014_356. ISBN:978-3-662-46189-1. PMC:4501231. PMID:25604619.
- ^ ا ب Bokhari MR، Samanta D، Bokhari SR (2021). Canavan Disease. Treasure Island (FL): StatPearls Publishing. PMID:28613566. مؤرشف من الأصل في 2021-01-26.
{{استشهاد بكتاب}}:|عمل=تُجوهل (مساعدة) - ^ Matalon R, Michals K, Kaul R (Oct 1995). "Canavan disease: from spongy degeneration to molecular analysis". The Journal of Pediatrics (بالإنجليزية). 127 (4): 511–7. DOI:10.1016/S0022-3476(95)70105-2. PMID:7562269.
- ^ ا ب Matalon R, Delgado L, Michals-Matalon K (Jan 2020). "Chapter 66 - Canavan disease". Rosenberg's Molecular and Genetic Basis of Neurological and Psychiatric Disease (بالإنجليزية) (Sixth ed.). Academic Press. pp. 909–916. ISBN:978-0-12-813955-4.
- ^ Kantor B، McCown T، Leone P، Gray SJ (1 يناير 2014). "Clinical applications involving CNS gene transfer". Advances in Genetics. ج. 87: 71–124. DOI:10.1016/B978-0-12-800149-3.00002-0. ISBN:9780128001493. PMC:4518844. PMID:25311921.
- ^ Traeger EC، Rapin I (مارس 1998). "The clinical course of Canavan disease". Pediatric Neurology. ج. 18 ع. 3: 207–12. DOI:10.1016/s0887-8994(97)00185-9. PMID:9568915.
- ^ Wang J، Leone P، Wu G، Francis JS، Li H، Jain MR، وآخرون (يناير 2009). "Myelin lipid abnormalities in the aspartoacylase-deficient tremor rat". Neurochemical Research. ج. 34 ع. 1: 138–48. DOI:10.1007/s11064-008-9726-5. PMC:4640699. PMID:18478328.
- ^ "Aspartoacylase Deficiency (Canavan Disease) | The Online Metabolic and Molecular Bases of Inherited Disease | OMMBID | McGraw-Hill Medical". ommbid.mhmedical.com. مؤرشف من الأصل في 2021-04-16. اطلع عليه بتاريخ 2021-04-15.