تساوي إلكتروني
في الكيمياء، توصف الكيانات الجزيئية من ذرّات وجزيئات وأيونات على أنها متساوية إلكترونياً مع بعضها البعض إذا كان لها نفس العدد من الإلكترونات،[1] أو لديها نفس التوزيع الإلكتروني ونفس البنية، وذلك بغض النظر عن نوع العناصر الداخلة في التركيب.
يستخدم مصطلح التساوي الإلكتروني التكافؤي عندما يكون للكيانات الجزيئية نفس العدد من إلكترونات التكافؤ أو نفس التوزيع الإلكتروني، ولكن لها عدد مختلف من الذرات أو نوع محتلف من الترابط الكيميائي.[2]
تفيد معرفة ظاهرة التساوي الإلكتروني في إجراء حسابات على الجزيئات وعلى الكثافة الإلكترونية، وبالتالي دراسة إمكانية حدوث التفاعلات بين الأنواع الكيميائية.
أمثلة
عدلإن ذرة النتروجين N والأيون الجذري للأكسجين +O هما متساويان إلكترونياً، لأن لهما نفس العدد من الإلكترونات (5) في غلاف التكافؤ. بشكل مشابه، فإن الكاتيونات التالية +K و2+Ca و3+Sc وكذلك الأنيونات التالية -Cl و2-S و3-P هي متساوية إلكترونياً مع ذرة الآرغون Ar.
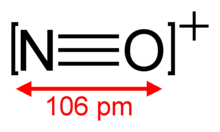
من الأمثلة على التساوي الإلكتروني أيضاً كل من جزيء أحادي أكسيد الكربون CO والنتروجين N2 وكاتيون نتروزونيوم +NO، حيث أن جميعها مؤلفة من نواتين لها عشرة إلكترونات تكافؤية. لا يتعلق التساوي الإلكتروني بالشحنة الأساسية على الذرات في البنية.
من الأمثلة الأخرى على هذه الظاهرة، وجود التساوي الإلكتروني بين جزيء الإيثنون H2C=C=O والأيون الهجين ديازو الميثان −H2C=N+=N. بالمقابل، فإن الأسيتون CH3COCH3 وثنائي ميثيل الديازين CH3N2CH3 غير متساوية إلكترونياً، وذلم على الرغم من أن لها نفس العدد من النوى ومن إلكترونات التكافؤ، لكن ارتباط الذرات مختلف، أي أن البنية مختلفة. ففي المركب الأول تكون البنية الجزيئية ثلاثية مستوية تكون الوحدات البنائية فيها مرتبطة بذرة الكربون المركزية، في حين أنها في الأخير خطية نتيجة الرابطة N=N ومتفرعة عند مجموعات الميثيل الطرفية.
المراجع
عدل- ^ Isoelectronic Configurations iun.edu نسخة محفوظة 17 يوليو 2017 على موقع واي باك مشين.
- ^ Advances in Organonmetallic chemistry. F.G.A. Stone page 190 google books link نسخة محفوظة 21 ديسمبر 2014 على موقع واي باك مشين.