ثييران
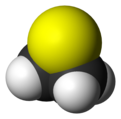
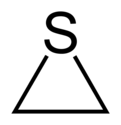
ثييران هو مركب عضوي حلقي غير متجانس مشبع له الصيغة الكيميائية C2H4S.
| ثييران | |
|---|---|
 |
 |
| تسمية الاتحاد الدولي للكيمياء | |
Thiirane[1] |
|
| أسماء أخرى | |
2,3-Dihydrothiirene[1] Ethylene sulfide[1] |
|
| المعرفات | |
| رقم CAS | 420-12-2 |
| بوب كيم (PubChem) | 9865 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C2H4S |
| الكتلة المولية | 60.12 غ/مول |
| المظهر | سائل أصفر |
| الكثافة | 1.01 غ/سم3 |
| نقطة الانصهار | −109 °س |
| نقطة الغليان | 55–56 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
يتألف المركب بنيوياً من حلقة ثلاثية حاوية على ذرة كبريت واحدة، وهو يعد أبسط المركبات الحلقية الحاوية على الكبريت،[4] وتسمى مشتقات المركب باسم ثييرانات.
التحضير
عدليحضر الثييران من تفاعل كربونات الإيثيلين مع ثيوسيانات البوتاسيوم؛[5] حيث يعالج KSCN حرارياً لينصهر في الأول تحت الفراغ لإزالة الماء، ويتشكل سيانات البوتاسيوم بالإضافة إلى ثنائي أكسيد الكربون:
كما يمكن أن تتم عملية التحضير من تفاعل أكسيد الإيثيلين (الأكسيران) مع ثيويوريا في وسط مائي وبالتبريد، ويحصل على اليوريا كناتج ثانوي في العملية:[6]
الخواص
عدليوجد مركب ثييران في الشروط القياسية على شكل سائل أصفر اللون له رائحة منفرة. يبلغ طول الرابطة كربون-كبريت 181.9 بيكومتر، أما الرابطة كربون-كربون في المركب فطولها 149.2 بيكومتر؛ قي حين أن زاوية الرابطة C-S-C تبلغ 65°.[7]
يتفاعل الثييران مع النكليوفيلات (محبات النوى) في تفاعل فاتح للحلقة، والذي يستخدم في تحضير الثيولات.
فعلى سبيل المثال يحدث تفاعل إضافة مع الأمينات ليشكل مركبات 2-مركبتو إيثيل أمين،[8] والتي تعد من الربيطات المتمخلبة الجيدة.
أما مع الإيمينات فيتفاعل ليشكل مشتقات ثيازوليدين.[9]
ديثييران
عدلتعرف مركبات ديثييران Dithiiranes عندما يكون هناك ذرتي كبريت في الحلقة الثلاثية؛ ويحصل عليها عند أكسدة ديثييتان (حلقة رباعية مشبعة حاوية على ذرتي كبريت).[10]
اقرأ أيضاً
عدلالمراجع
عدل- ^ ا ب ج د "thiirane (CHEBI:30977)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. مؤرشف من الأصل في 2016-03-04.
- ^ ا ب ج Thiirane (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Warren Chew; David N. Harpp (1993). "Recent aspects of thiirane chemistry". Journal of Sulfur Chemistry. ج. 15 ع. 1: 1–39. DOI:10.1080/01961779308050628.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ (1973)"Ethylene Sulfide". Org. Synth.; Coll. Vol. 5: 562.
- ^ J. F. Olin, F. B. Dains in: J. Am. Chem. Soc. 1930, 52, 3322–3327. دُوِي:10.1021/ja01371a047
- ^ G. L. Cunningham, A. W. Boyd, R. J. Myers, W. D. Gwinn in: J. Chem. Phys. 1951, 19, 6, 676–685; دُوِي:10.1063/1.1748331.
- ^ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4.
- ^ M. D. Rozwadowska, A. Sulima in: Tetrahedron 2001, 57, 3499–3506. دُوِي:10.1016/S0040-4020(01)00224-1
- ^ Ahhiko Ishii, Masamatsu Hoshino, and Juzo Nakayama "Recent Advances in Chemistry of Dithiirane and Small Ring Compounds Containing Two Chalcogen Atoms" Pure & Appl. Chem., 1996, volume 68, pp. 869-874.دُوِي:10.1002/chin.199650272
| ثييران في المشاريع الشقيقة: | |
| |
