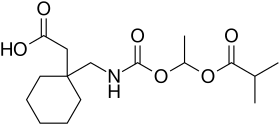
غابابنتين إيناكاربيل
غابابنتين إيناكاربيل Gabapentin enacarbil المعروف سابقا باسم XP- 13512, هو طليعة دواءللغابابنتين مضاد الاختلاج ومسكن الألم.[5] تم تصميمه لزيادة التوافر البيولوجي عن طريق الفم للغابابنتين، وأظهرت التجارب على الإنسان أنه يعطي تحرير مديد للغابابنتين مع ما يقارب ضعف التوافر البيولوجي بشكل عام، لا سيما عندما يؤخذ مع وجبة دسمة. لقد مر الغابابنتين إيناكاربيل بتجارب سريرية على البشر لعلاج متلازمة تململ الساقين، وأظهرت النتائج الأولية أنه يبدي تحملا جيدا وفعالة بشكل مقبول.[6][7][8]
| غابابنتين إيناكاربيل | |
|---|---|
| اعتبارات علاجية | |
| معرّفات | |
| CAS | 478296-72-9 |
| بوب كيم | 9883933[1] |
| درغ بنك | DB08872 |
| كيم سبايدر | 8059607[2] |
| المكون الفريد | 75OCL1SPBQ |
| كيوتو | D09539[3] |
| ChEMBL | CHEMBL1628502[4] |
| بيانات كيميائية | |
| الصيغة الكيميائية | C₁₆H₂₇NO₆[1] |
| تعديل مصدري - تعديل | |
تم رفض قبول الدواء من قبل الإدارة الغذاء والدواء الأميركية في شهر شباط 2010, مشيرة إلى مخاوف من احتمال زيادة خطر الإصابة بالسرطان كما أظهرت بعض الدراسات على الحيوانات. أثيرت مخاوف مماثلة بشأن الغابابنتين نفسه في الماضي، بالنسبة لاستخدامه كمضاد اختلاج، في حين أن استخدامه لعلاج متلازمة تململ الساقين لم يبدي نفس النوع من المخاطر.[9]
في 6 أبريل 2011، تلقت شركة Xenoport موافقة الإدارة الغذاء والدواء على الدواء Horizant (غابابنتين إيناكاربيل) لعلاج متلازمة تململ الساقين المعتدلة إلى الشديدة.[10] في 7 يونيو 2012، وافقت إدارة الغذاء والدواء الإدارة الغذاء والدواء على استخدام Horizant لعلاج الألم العصبي التالي للهربس في البالغين.[11]
المصادر
عدل- ^ ا ب ج د Gabapentin enacarbil (بالإنجليزية), QID:Q278487
- ^ Gabapentin enacarbil، QID:Q2311683
- ^ gabapentin enacarbil، QID:Q6120337
- ^ GABAPENTIN ENACARBIL، QID:Q6120337
- ^ Landmark CJ, Johannessen SI (2008). "Modifications of antiepileptic drugs for improved tolerability and efficacy". Perspectives in Medicinal Chemistry. ج. 2: 21–39. PMC:2746576. PMID:19787095.
- ^ Merlino G, Serafini A, Lorenzut S, Sommaro M, Gigli GL, Valente M (يناير 2010). "Gabapentin enacarbil in restless legs syndrome". Drugs of Today (Barcelona, Spain : 1998). ج. 46 ع. 1: 3–11. DOI:10.1358/dot.2010.46.1.1424766. PMID:20200691.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Bogan RK, Bornemann MA, Kushida CA, Trân PV, Barrett RW (يونيو 2010). "Long-term maintenance treatment of restless legs syndrome with gabapentin enacarbil: a randomized controlled study". Mayo Clinic Proceedings. Mayo Clinic. ج. 85 ع. 6: 512–21. DOI:10.4065/mcp.2009.0700. PMC:2878254. PMID:20511481.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Imamura S, Kushida C (أغسطس 2010). "Gabapentin enacarbil (XP13512/GSK1838262) as an alternative treatment to dopaminergic agents for restless legs syndrome". Expert Opinion on Pharmacotherapy. ج. 11 ع. 11: 1925–32. DOI:10.1517/14656566.2010.494598. PMID:20629607.
- ^ GlaxoSmithKline/XenoPort: FDA setback halts gabapentin reformulations [وصلة مكسورة] نسخة محفوظة 14 أبريل 2020 على موقع واي باك مشين.
- ^ [1][وصلة مكسورة] نسخة محفوظة 11 مايو 2020 على موقع واي باك مشين.
- ^ Jeffrey، Susan. "FDA Approves Gabapentin Enacarbil for Postherpetic Neuralgia". Medscape. مؤرشف من الأصل في 2014-06-13.