ميثانول
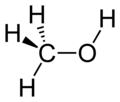
الميثانول أو الكحول الميثيلي مركب هيدروكربوني يتألف من الكربون والهيدروجين والأكسجين الذي ينتمي إلى صنف الكحولات صيغته CH3OH.
| ميثانول | |
|---|---|
 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
ميثانول |
|
| أسماء أخرى | |
كحول ميثيلي |
|
| المعرفات | |
| رقم CAS | 67-56-1 |
| بوب كيم | 887[1] |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | CH3OH |
| الكتلة المولية | 32.04 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.79 غ/سم3 |
| نقطة الانصهار | − 98 °C |
| نقطة الغليان | 65 °C |
| الذوبانية في الماء | يمتزج مع الماء |
| الذوبانية | يمتزج مع الإيثانول والإيثر الإيثيلي |
| حموضة (pKa) | 15.5 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
يدعى أيضا «كحول الخشب» لإمكانية تحضيره من التقطير الإتلافي للخشب (أو حرق الخشب وتقطيره بعزله عن الهواء)،بحيث يعدّ من أحد العناصر المكونة للكثير من المركبات الكيميائية والمنتجات ذات الاستعمال اليومي، ويمكن استخدامه لأغراض كثيرة بما في ذلك الصناعة.
لمحة تاريخية
عدلاستعمل الميثانول في عملية التحنيط التي كانوا يمارسونها قدماء المصريون بحيث تم عزل الميثانول النقي لأول مرة سنة 1661 من قبل روبرت بويل الذي اعطاه اسم روح الخشب.
تفاعلات الكيميائية للميثانول
عدلالميثانول يتفاعل مع المواد الكيميائية الأخرى من بينها:
تفاعل الأكسدة ينتج عن أكسدة الكحول الميثيلي مادة الميثانال(فورمالدهيد) حيث يعد مكونا مهما في صناعة اللدائن، مانع تآكل المعادن، صناعة المواد الصيدلانية...الخ، حسب المعادلة التالية:
2CH3OH + O2 → 2H2CO + 2H2O
تفاعل الميثانول مع أول أكسيد الكربون مفاعلة الكحول الميثيلي مع أول أكسيد الكربون ينتج حمض الخليك، الذي يستخدم في إنتاج الأسبرين، مواد المساعدة في صناعة الورق، صناعة خلات السليولوز التي تستخدم في صناعة الألياف...الخ.
تفاعل الميثانول مع كلوريد الهيدروجين ينتج عن هذا التفاعل مادة كلوريد المثيل، التي تستخدم في صناعة السيلكون، إضافة إلى صناعة مطاط البيوتيل...الخ، حسب المعادلة التالية:
CH3OH + HCl → CH3Cl +H2O
تفاعل الميثانول مع الأمونيا ينتج من مفاعلة الأمونيا مع الكحول المثيلي مادة أمينات الميثانول. وتستخدم في إنتاج مبيدات الحشرات، وفي دباغة الجلود...الخ.
تفاعل الميثانول مع الايزوبيوتيلين تنتج عنه مثيل ثلاثي بيوتيل الايثر، يستخدم كمذيب، وفي الصناعات البتروكيماوية...الخ.
تفاعل الميثانول مع الزايلين المؤكسد ينتج عن هذا التفاعل مادة ثنائي مثيل ترفثاليت، تستخدم لإنتاج ألياف البولي استر، صناعات علب الأغذية والمشروبات...الخ.
صناعة الميثانول
عدلهناك طريقتين لإنتاجه:
طريقة مخبرية يتم تحضير الميثانول في المخبر انطلاقا من تفاعل كلور المثيل مع هيدروكسيد الصوديوم حسب المعادلة التالية :
CH3Cl + NaOH → CH3OH + NaCl
طريقة صناعية يصنع الميثانول من غاز التشييد منذ عام 1923 بالطريقة نفسها التي ينتج بها اليوم وتتم عملية تصنيعه وفق الخطوات التالية :
1-مرحلة تنقية الغاز الطبيعي من مركبات الكبريت والكلور׃وهي مرحلة desulphurization ويتم التخلص من المركبات الكبريتية الموجودة مع الميثان عن طريق استخدام الكربون المنشط.
2-مرحلة التشكيل الكيميائي للغاز الطبيعي׃وتتم عن طريق تسخين الميثان ومزجه مع ثاني أكسيد الكربون وبخار الماء ويمرر الخليط فوق عامل مساعد مثل النيكل، يؤدي وجود المركبات الكبريتية إلى تسمم العامل المساعد وبالتالي يقلل أو يعدم فعاليته، يجري التفاعل عند درجة حرارة بحدود 800˚م فيتحول الميثان إلى أول اوكسيد الكربون والهيدروجين(غاز التشييد)كما هو موضح في المعادلة التالية ׃
غاز التشييدهو خليط غازي أول أكسيد الكربون والهيدروجين وينتج بواسطة تفاعل الغاز الطبيعي مع بخار الماء عن طريق عمليتين׃
أ-عملية التعديل ببخار الماء: هذه العملية حفزية، يستعمل حافزات تحتوي على أكسيد النيكل، تتم حسب المعادلة التالية:
ب-عملية الأكسدة الجزيئية :تعد هذه العملية أحدث من التعديل ببخار الماء، إلا أن الأخيرة أوسع انتشارا حتى الآن، وقد زاد انتشار الاكسدة الجزئية بعد أن أصبح الأكسيد رخيص الإنتاج حالياً، حسب المخطط التالي:
4-مرحلة إنتاج الميثانول الخام بمفاعل إنتاج الميثانول.
5-مرحلة التقطير وتنقية الميثانول الخام والوصول به إلى المنتج النهائي حسب المواصفات العالمية.
ويحتوى مخرج التفاعل على 5 - 20 % ميثانول فقط، إذ أن عملية التحويل تتم في اتجاه واحد ببطء، وبعد التبريد وخفض الضغوط يزال الميثانول السائل وتنقيته بالتقطير، باقي غاز التشييد غير المتفاعل يتم تدويره إلى المفاعل مرة أخرى، كما هو موضح حسب التصميم التالي׃
النقــــل والتوزيع
عدلفي كل خطوة من وسائل النقل والتوزيع، الميثانول ينبغي تخزينه للتعامل معه بأمان لتقليل المخاطر التي يتعرض لها الإنسان والبيئة والحفاظ على وسائط النقل(بري أو بحري) لمعظم الميثانول الأكثر شيوعا في العالم.
استعمالات الميثانول
عدليستخدم في عدة مجالات عديدة منها : أ-يستخدم كمادة خام في العديد من الصناعات الكيميائية مثل صناعة فورمالدهيدو حامض الخليك.
ب-صناعة المستحضرات الطبية.
ج-صناعة اللدائن (البلاستيك).
د-تطبيقات في خلايا الوقود،التي تعتمد على تفكيك الميثانول لتوليد الطاقة.
ه-مذيب جيد لبعض المواد العضوية.
و-يستخدم في رش الاسطح الخارجية للطائرات لازالة الجليد عنها حيث يذوب الميثانول في الجليد (الماء) فتنخفض درجة تجمد المحلول (انصهار الجليد).
ن-وقود عالي النقاوة لبعض الالات، السيارات، في المنازل.
تأثير الميثانول على جسم الإنسان
عدلالميثانول بذاته غير سام ويرجع التأثير السام لنواتج الأيض حيث يتأيض الميثانول إلي مادة شديدة السمية الفورمالدهيد حيث يعدّ 33 مرة أكثر سمية من الإيثانول ويتحول الفورمالدهيد بسرعة إلى حمض النمليك خلال 3 دقائق، الميثانول سريع الامتصاص من الجهاز الهضمي حيث يصل إلى أعلى معدل له في الدم بعد نصف ساعة أو ساعة، يعتمد علي وجود أو عدم وجود الطعام في المعدة ويحدث التسمم عادة في فترة تتراوح من 6 ساعات إلى ثلاثة أيام وخلال هذه الفترة لا يشتكي الشخص من أي أعراض سمية.
ويرجع الأثر السام للميثانول إلى تحوله في جسم الإنسان إلى فورمالدهيد وحمض فورميك بواسطة إنزيم نازع هيدروجين الكحول بالكبد يُعد تراكم النواتج الاستقلالية السامة للميثانول مسؤولة عن ظهور أعراض وعلامات التسمم به.وأهم هذه النواتج الفورمالدهيد الذي له تأثير إتلافي على العديد من خلايا الجسم وبخاصة شبكية العين والعصيات البصرية بالإضافة إلى حدوث الحماض بسبب تكون حمض الفورميك. وعلى ذلك فأعراض التسمم بالميثانول تبدأ في الظهور بعد فترة تتراوح بين 12 و 14 ساعة من تعاطيه على شكل صداع ودوار وغثيان وقيء وآلام شديدة بالبطن والظهر تعزى إلى التهاب البنكرياس، وتظهر أعراض تثبيط الجهاز العصبي المركزي والفشل التنفسي. ومن العلامات الثابتة للتسمم بالميثانول الاضطراب البصري.
تأثيره على البيئة
عدليعدّ الميثانول من ملوثات البيئة، فهو يتحلل بسهولة في الماء والتربة، بتراكيزعالية مما يؤدي إلى تلوث المياه العذبة والمالحة مما يؤثر على الحياة المائية خاصة في المناطق المجاورة للتفريغ. وعادة ما يتبخر الميثانول عند تركه معرضا للجو، ويتفاعل مع الهواء مكونا الفورمالدهيد والذي يساهم بدوره في تلويث الهواء. كما أنه يمكن أن يتفاعل مع عدد من الكيماويات التي يحتويها الهواء الجوي أو يمتص في مياه الأمطار. والميثانول يسهل التخلص منه في التربة والمياه وذلك بواسطة الكائنات التي تتغذى عليه.
ما زالت عملية تصنيع الميثانول مكلفة، وتجرى البحوث حاليا لاكتشاف حفاز يسمح بتحويل الميثان مباشرة إلى ميثانول دون أن يرتد التفاعل. وما زال الأمل معقودا لتحقيق تقدم في هذا المجال.
اقرأ أيضا
عدلمراجع
عدل